2019年8月26日,新修订的《中华人民共和国药品管理法》审议通过,提出“药品上市许可持有人、药品生产企业、药品经营企业和医疗机构应建立并实施药品追溯制度,按照规定提供追溯信息,保证药品可追溯”。通过对国内外药品跟踪与追溯系统现状,特别是体系成熟的美国和欧盟的现行成果进行研究,来规范我国的药品追溯管理。
国外药品追溯监管现状
日本建立上市药品安全管理规范
日本厚生劳动省(MHLW)一直鼓励在药品包装上使用条码。国际物品编码组织(GS1)提倡使用GS1 Data Matrix作为包裹和数字链路的唯一条码。现在,日本产品主要使用JAN代码,JAN代码与GTIN-13码制完全相同,相互通用。在日本若经过《药品临床试验管理规范》鉴定,也可以使用GTIN-13代码。日本每一个营销业务许可证持有人都已获得《药品临床试验管理规范》认证,因此GTIN-13已经与JAN通用。新法案还明确规定,处方药和药品的包装上必须有条码以确保安全,法案还指出处方药和药品的包装说明必须以电子方式提供,且提供条码。
美国多措并举降低药品安全隐患
美国颁布了《药品供应链安全法》,法律规定适用于制造商、分装商、批发分销商和第三方物流供应商,采用GS1的标准体系,并且对供应链各节点做了详细的规定。
产品标识 制造商和分装商在处方药包装上使用唯一的产品标识,例如,易于电子阅读的条码。
产品验证 制造商、批发商、药品分销商、分装商和零售商(主要是药房)建立系统和流程,以便能够验证处方药包装上的产品标识。
产品追踪 药品供应链中的制造商、批发商、药品分销商、分装商和零售商(主要是药店)提供有关药品的信息,同时提供市场销售时经办人的信息。
检测和应对 生产商、批发商、药品分销商、分装商和零售商(主要是药店)对已被确定为可疑药物(即可能是假冒、未经批准或具有潜在危险性)的药品进行检疫和及时调查。
通知 制造商、批发商、药品分销商、分装商和零售商(主要是药房)建立系统和流程,以便在发现非法药物时通知美国食品药品监督管理局(FDA)和其他相关方。
批发商许可 批发商向FDA报告其许可状态和联系方式。这些信息还将在公共数据库中公布。
第三方物流供应商许可证 第三方物流供应商,提供与药品分销相关的储存和物流操作,以获得州或联邦药品物流许可证。
欧盟开发药品电子监管系统
低成本“发药点验证”
2011年7月,欧洲议会和欧盟理事会通过了《欧盟反伪造药品指令》(The EU Falsified Medicines Directive,DIRECTIVE2011/62/EU),明确要求为欧盟境内流通的每一份药品建立“可供验证其真实性”的安全档案,并建立一个欧盟国家通行的数据库,储存药品安全信息。该法案的颁布为欧洲药品电子监管系统的实施奠定了法律基础。
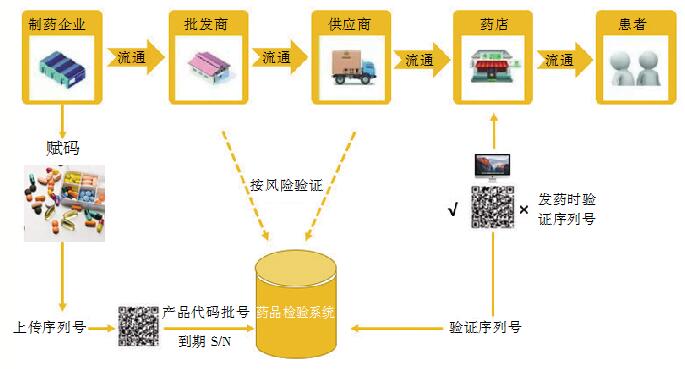
欧洲药品电子监管系统利用“二维码” (Data Matrix)对单件药品进行赋码,采用“发药点验证”模式,由药品供应系统中的各利益相关者共同管理,如图1所示。通过强制实行发药前监管码信息验证,以实现对药品的安全监管及流向的追溯。该模式运行多年,在欧洲各国受到广泛认可,目前已基本实现全面覆盖。
图1 欧盟处方药跟踪与追溯系统运行图
统一编码标准
起初,欧洲多国各自的药品电子监管系统并没有统一的编码标准。其中,英国以及许多中欧、东欧国家采用的是GS1标准;包括瑞士在内的多数北欧国家则使用由北欧物品编码局统一管理的Nordisk Vare码;另一些欧洲国家则构建了本国独有的编码结构。此外,各国要求的编码放置方式也不尽相同,使一些药品生产企业为符合欧洲各国的编码要求,有的药品包装上不得不使用6-7种不同的药品编码,这大大增加了制造成本及追溯难度。
因此,欧洲制药工业协会联合会(European Federation of Pharmaceutical Industries and Associations,EFPIA)于2006年2月联合药品供应链中各利益相关集团,着手建立一套在欧洲范围内通行的药品电子监管系统,即欧洲药品验证系统(European Medicines Verification System,EMVS)。基于成本——效益最大化的理念,EMVS选择国际通用的二维码作为其信息载体,运用GS1标准体系,采用“发药点验证”的运行方法,由药品供应系统中的各利益相关者共同管理。
成立指导委员会
欧盟2008年9月成立了专门的EMVS系统指导委员会。该委员会由欧洲制药工业协会联合会(EFPIA)、欧洲制药联盟(PGEU)和欧洲药品批发企业联盟(GIRP)作为正式成员,欧洲仿制药商联盟(EGA)作为观察员,4个机构共同组成。各机构分别代表原研药商、药房、药品批发企业和仿制药商的利益,对EMVS的推行事宜进行指导和决策。
相对均衡的机构设置,有效平衡了各大集团的利益,有利于药品电子监管制度的积极推行。在EMVS系统指导委员会的指导和协助下,欧盟还将建立欧洲药品验证组织(European Medicines Verification Organization,EMVO)。该组织的主要任务是建立和管理欧洲药品编码中心。欧洲药品编码中心是药品生产商和平行进口商的数据传输门户,欧盟境内所有生产商和平行进口商统一通过该中心上传或验证药品信息;其下接若干国家系统或国家蓝图系统。
对药品商的要求
药品生产商必须在药品出厂前将储存药品信息的二维码印在每盒药品的次级包装上,即与药物直接接触的包装组件上。根据《欧洲药品包装编码指南》(European Pack Coding Guidelines Specification),二维码编码结构必须符合GS1标准,包含的药品信息有:该药品的全球贸易项目代码(Global Trade Item Number,GTIN)、药品序列号、药品失效日期和药品批次。其中,药品序列号是电子监管系统识别药品的重要标识,要求互不重复。为防止造假者按规律推算药品序列号,其生成过程完全随机,且须在药品超过保质期7年后其序列号才能被重复使用。赋码完成后,生产商需要通过扫描条码完成药品与序列号的相互关联,并将编码信息发送至欧洲药品编码中心数据库。
药品供应链中的其他参与者(如批发商)在取得系统认可后,可自愿在任何时候通过扫描药品包装上的二维码发出验证请求,以确认药品信息。EMVS指导委员会计划在EMVS系统运行的第二阶段,由药品分销商通过已有数据交换网络添加相关信息,进而建立药品全程追踪系统。
对药品销售商的要求
以医院药房和零售药店为主的药品销售商在追溯系统中扮演着十分重要的角色。根据《欧洲药品验证系统实施阶段信息传输要求》(European Medicines Verification System-Implementation Phase:Request for Information)的规定,药剂师在发售药品前,须先扫描药品包装上的二维码。经扫描,系统会将检测到的药品信息与中心数据库中的信息相对比。如果扫描到二维码中的信息与数据库中的信息相符,并且满足其他标准(如“药品在保质期内”和“药品不在召回范围内”),药剂师可将药品发售给患者,此数据库中的药品状态自动改为“已发售”。
如果扫描到二维码中的信息与数据库中的信息不相符(如显示“数据库中不存在该序列号”)或者该序列号所代表的药品状态为“已发售”,则说明该药品有可能是假药。这时,药剂师应拒绝将该药品发售给患者。系统会自动向该药品的制造商发出假药警报。
我国药品追溯与监管现状
近年来,药品风险在临床使用中日益增加;监管部门对产品上市后的监控要求也在不断加强;需要加强和完善药品生产企业对产品的可追溯和产品召回的管理,生产企业产品销售到代理商、经销商分销记录填写不完善致使无法追溯到临床使用,从而无法完成召回,这些问题亟需解决。
药品监管存在法律法规不完善、缺乏监管手段等。目前大多数药品采用粗放式管理,供应商以次充好的情况无法杜绝,出现问题后又难以及时查找,造成管理混乱。
我国迫切需要建立一套统一的编码标准体系,选择与之相配套的追溯模式,当然也需要一个基于此追溯系统的合理、科学、有效的药品管理实施方案,并加强相关制度建设。
我国药品追溯管理建议
使用GS1国际标准编码,重视不同包装等级药品监管
GS1国际标准的使用使得全球彼此协作的产品标识、数据采集和共享成为可能。这也为全球医疗供应链的效率提升和成本效益管理提供了支持。GS1标准的使用也有助于监管要求统一实施。
现今的监管要求侧重于贸易项目和药品的二级包装。特别要注意的是,为实现可追溯,像条码这样的数据载体应放在注册包装等级上,这与销售许可档案中的药品描述有关,无论是否为销售单元。
初级包装 与产品“直接接触”的一级包装,包含产品本身。包装级别应采用 GS1 Data Matrix条码,直接在包装或在包装附带的标签上进行标记。初级包装的编码不在药品可追溯性要求范围内,目前暂无在初级包装上进行标识和标记的推荐。
二级包装 通常称为项目级别,是可能包含一个或多个初级包装,或一组包含单个项目的初级包装的包装级别。此包装级别建议直接在包装上或附于包装的标签上标记GS1 Data Matrix 条码。
三级包装 指包装等级的最高级。三级包装可以是:包含一个或多个二级包装的箱子;包含一个或几个箱子的托盘。三级包装可以是物流单元或贸易项目。
全球大约70个经济体要求或允许使用GS1标准来实施医疗要求。世界各地的大多数可追溯性法规均与二级包装上的标识和条码应用的全球趋势保持一致:采用包含GTIN、批号、失效日期和序列号的GS1 Data Matrix条码。使用GS1 Data Matrix的优势在于:在最小的“占用空间”中采集最大量的数据;可直接印刷在产品上;具有复杂的错误检测和校正算法,即使损坏、撕裂或印刷不清也能被识读。
确定数据产品的识别依据及所使用的标准
建议将此类编码与标识其商业形式的特定产品代码相关联(例如GTIN),这样就可以获得同一产品系列的统计数据。在所有情况下,产品代码和序列代码的关联必须是唯一的,并且只能使用一次。其次,对批号、生产日期、有效期、产品注册号、用于社会保障或健康计划的产品标识或者产品标识中未包含的数据进行可选或强制编码,并将数据输入到数据库中。将批次数据加入到数据库中(无论数据载体上是否可用),有关批次和有效期的数据通常是最重要的,使产品能够更有效地进行市场召回跟踪。最后,有效期标识将加强对过期产品的预防和库存管理,从而避免因过期而造成的损失。
通过使用GS1国际标准,一方面,整个医疗服务供应链的利益相关方可以防止伪造、销售、转售药品,使药品更安全。另一方面,可以减少药品短缺,提高供应链流程效率,为医疗保险提供高质量数据。最后,为管理机构提供统计数据,以制定合理的战略规划和用药政策。同时,我国政府也应该加速制定GS1平台下的药品政策法规,旨在建立一套以GS1为依托的药品追溯体系,通过政策,提高药品合法性、质量和疗效,确保患者用药的安全性。
陈浩 李勋 刘文博
作者单位:青岛市标准化研究院
《中国自动识别技术》2022年第1期总第94期