专家小组成员

Craig Stobie,全球行业总监(左一) Volker Watzke,欧盟医疗器械部门经理(中间) Bart Vansteenkiste,全球生命科学部门经理(右一)
问:什么是欧盟医疗器械新法规?
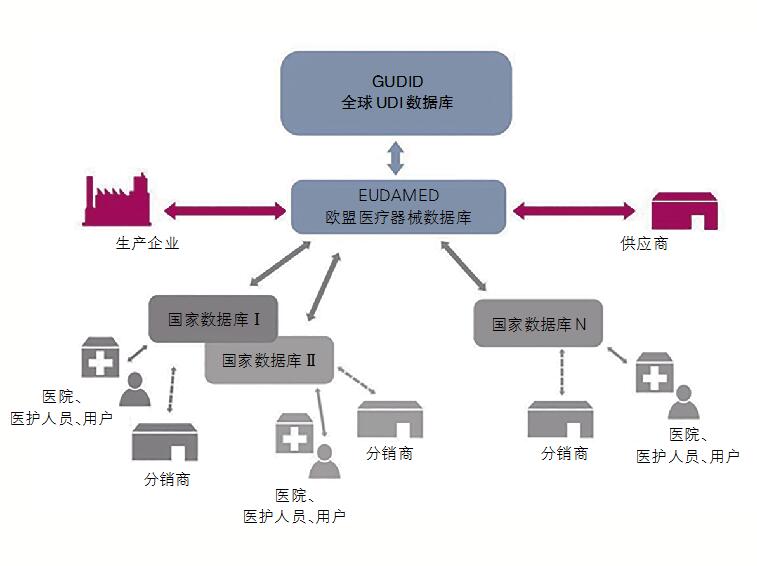
专家小组:从2022年5月26日起,在欧盟成员国销售的所有医疗设备都需要包含UDI,并需要记录在EUDAMED的欧盟数据库中,即欧洲医疗器械数据库。随着这些法规的生效,制造商需要为在包装上赋可追溯码寻求一种解决方案。
买家和医院有义务拒绝未达到此标准的产品。这意味着,所有想要向欧盟销售产品的制造商,即使在欧洲以外的国家也都需要满足这些要求。
医疗器械制造商还需要确保每个产品的UDI都在欧盟数据库中有注册记录。不然,制造商将不再能够向其他欧盟成员国销售其产品。
这个数据库守护着患者的安全。
Watzke说:“我最近读到的一篇文章指出,大多数当局不知道有多少医疗器械在他们的国家出售。例如,德国不知道这个数字,可能在70万至150万之间。”
互联世界
专家小组:医疗行业正处于从手动记录数据到数字记录数据的转变中,有关互联医疗设备的数据也有所增加。医疗器械发展协会最近发表的一篇文章,即软件与召回峰值,说到由于设备软件问题导致医疗设备召回的问题不断增加,引发了对患者安全潜在问题的讨论。
Vanstenkiste说:“随着这些设备的互联,并接入物联网,这会带来额外的风险。比如说如果我有一台电脑,我知道你有一个医疗产品,并且它是连接到互联网的,可能,我会尝试访问你的医疗设备并作一些不利的事情。毫无疑问,这是一个需要考虑的问题,但医疗器械在面临高风险处理时变得更智能,减少患者的风险。不过这些处理会损耗机器寿命,因此必须更加注重维护。”
问:另一个有趣的问题是互联医疗设备的隐私保护。对于包含关于您和您的医疗健康保险数据的医疗设备,是否有任何访问的规定和限制?
Watzke说:“不同的国家有不同的数据法规。在一些国家(如德国),访问数据可能更容易,而其他国家可能面临更严峻的数据监管问题。在某些国家/地区,产品与患者之间的联系可能相当困难。”
问:如果隐私法由设备原产国规定,那么是否会对已连接医疗设备的旅行者造成影响?如果患者前往其他国家度假,但数据不可用,是否会导致问题?
Watzke说:“我认为信息应该记录并保存在某处,也许在芯片卡上。无论患者身在何处,只要能提供数据,就能获得最佳的药品、医疗保健和医生服务,保证患者的利益。”
问:访问需要被允许,隐私也需要得到尊重。这为医疗设备软件和医疗设备连接的互操作性增加了一个全新的维度。
Vansteenkiste说:“我认为,如果数据可以从世界上任何地方的任何医院获得,那将会是好事。但是,就不同的立法而言,我认为,如果您携带所有数据在世界各地旅行,并且人们突然可以访问您的个人信息,那么可能会带来一些问题。”
倒计时开始
问:在类似行业,我们看到行业机构会就即将出台的法规向会员提供专业的咨询服务。例如,EMBO和欧洲药品能给其成员传达很明确的建议。医疗设备是否也有这样的机构?
Watzke说:“有一个机构MedTech,这是医疗器械行业的专业机构。但是由于我们有很多的分支,所以让大家都聚集在一起比较困难。”
专家小组:最近《欧盟医疗器械法规问题》一文,讨论了一些新欧盟MDR的议题,包括执行日期,现有的产品的重新注册问题。这迫使制造商利用保留条款推迟认证产品,并为自己争取更多时间来合规。
监管总监Oliver Bisazza也警告说,在2022年的最后期限之前,即使一些现在被广泛使用的医疗设备也可能会被停止使用。
Watzke说:“迫使大多数中小型企业来遵守法律,将是一个巨大的挑战。”
专家小组:由于新的要求和新的立法,这有可能影响产品的供应。有一个潜在的解决方案,可以是将某些产品的合规性期限移后。
Watzke说:“我们已经在美国看到过这种情况,一类产品的最后期限已经推迟了两年,从2018年推迟到2020年。”
创新的阻碍
专家小组:即将到来的最后期限并不是一些制造商面临的唯一问题,还有许多初创企业甚至都难以进入市场。这在很大程度上是由于没有公告机构—欧盟认证的组织,在产品投放市场之前先评估合格性。
英国的BSI是第一个被认可的公告机构。欧洲联盟其他50个公告机构仍在等待认证。与此同时,欧盟也公告了另外三个公告机构(TÜVSüd,Dekra IMQ)。根据《医疗器械指令》和《有源植入类医疗器械指令》,最初的57个公告机构中,只有38个根据医疗器械法规申请认证,而且这个数字正在下降。
随着越来越少的公告机构可以咨询,现在很难对新产品进行认证。特别是当你是一个初创公司,不为人所知,并且与这些机构也没有合作过。
Vansteenkiste说:“同样,这也会对欧洲市场上允许销售的现有产品产生影响。最后期限和制造商必须重新注册所有现有产品的事实可能会导致市场上产品缺乏。”
Watzke说:“立法规定,已经按照旧指令注册的产品正面临过渡期。市场上已有的一些产品可能会使用旧证书再持续销售两到四年。”
Vanstenkiste说:“作为制造商,您可能有一组产品即将到达最终日期,但您可能还有另外一组非常相似的产品,它们可能在两年、三年或四年内才到达最终日期。”
专家小组:标准缺乏一致性,事情变得更加复杂。
Watzke说:“有些产品被归类为III类产品,因为产品对患者有高风险,但在美国可能不是III类。此外,某些产品在美国并非医疗器械,在欧洲,是属于医疗器械。对于已经申请并在美国注册的制造商来说,这是另一个挑战。”
专家小组:在其它行业,我们看到行业机构向他们的成员提供咨询建议,但医疗器械行业却还未如此,事实证明,很难将不同分支的公司聚集在一起。
欧洲MedTech机构,医疗器械行业的专业机构,目前仅服务非常大的公司和少数欧洲组织。
复杂的条例
专家小组:MedTech新闻最近的一篇文章概述了欧盟MDR的一些最大挑战,即欧盟新MDR和IVDR的四大挑战,包括重新分类设备的问题;更高的临床检测要求;公告机构的需求增加;以及强调后市场监测。
问:MedTech所提出的四个挑战是行政责任,而真正的问题则更加根深蒂固。
Stobie说:“我们看到的是一些更深入的问题:包装的适用性,并在无菌环境中的各级包装上赋识别码。这不是一个合规项目;这是商业行为的根本变化。”
专家小组:整个生产过程现在属于更广泛的立法范围内。它不仅仅是一个制造过程或临床试验过程,它是整个产品生命周期。
欧盟MDR这样的法规在每个欧盟成员国都有法律约束力,并且将在规定日期生效。但是,在全球范围内,存在差异,即使在公司内部,医疗器械的类别也存在差异。
Stobie说:“有些部分是清楚的,有些部分仍然有待商议,每个公司需要有一个非常清晰的观点,将怎么计划他们的合规项目。”
专家小组:想要在全球分销设备的制造商面临额外的挑战,因为他们不仅需要遵守新的欧盟MDR,还需要遵守其他全球法规。在美国,该数据库称为全球UDI数据库或 GUDID。向欧盟和美国供应产品的制造商需要在GUDID和EUDAMED中分别注册其产品,实际上要执行两次相同的工作。将来,很可能会在其他国家(中国、日本、印度等)看到单独的数据库。
问:那么,制造商和公司可以做些什么来消除这种困惑呢?
Stobie说:“你有护理人员,有制造商,有医疗保健提供者,有卖医疗器械的人。在私人诊所,还有应用于非紧急事由的私人医疗设备,这增加了更多的复杂性。”
专家小组:所以,和合适人员交流至关重要。制造商可以与已经在美国通过GUDID注册的公司和人员交流,来寻求建议。也可以与公告机构接触,但这里引起进一步困扰的一件事是,公告机构目前通过认证产品来盈利。因此,制造商能够接触多个公告机构即如果一种医疗设备未被认证,他们可以选择下一个机构认证。
Watzke说:“这也需要再进行讨论。在我看来,应该只为某些市场或产品设立一个公告机构。公告机构之间的竞争也会对病人的健康产生负面影响。”
专家小组:如果您想了解有关欧盟MDR立法的含义及其如何影响您的业务,请与我们联系。我们的专家小组对欧盟的MDR有全面和透彻的了解,能够为您提供如何快速、高效的合规的帮助和建议。
(供稿单位:多米诺标识科技有限公司)